枯草芽孢杆菌guaA基因突变质粒的构建
来源:56doc.com 资料编号:5D28561 资料等级:★★★★★ %E8%B5%84%E6%96%99%E7%BC%96%E5%8F%B7%EF%BC%9A5D28561
资料以网页介绍的为准,下载后不会有水印.资料仅供学习参考之用. 密 保 惠 帮助
资料介绍
枯草芽孢杆菌guaA基因突变质粒的构建(论文12000字)
摘 要
腺苷(Adenosine)又称腺嘌呤核苷,由糖苷键连接腺嘌呤和核糖而成,是人体细胞中具有重要生理功能的内源性核苷。现阶段腺苷生产的主要方式是采用微生物发酵法,但由于野生菌株的局限性导致其发酵产量较低,且产量不稳定,因此通过分子生物学手段人为地调控发酵菌株合成腺苷的代谢途径,以此提高发酵产量。本实验拟根据单交换和双交换同源重组技术构建两个定向敲除腺苷合成途径中GMP合成酶基因guaA的基因突变质粒,为下游通过分子生物学手段人为地调控发酵菌株合成腺苷的代谢途径提供基础。
关键词:腺苷 代谢 突变 单交换同源重组 双交换同源重组
Construction of Bacillus subtilis guaA gene mutation plasmid
Abstract
Adenosine, the abbreviation of adenine nucleoside, linked by glucosidic bond and adenine, is an endogenous nucleoside with important physiological function in human cells. The main way of adenosine production at the present stage is a use of microbial fermentation. However, the limitation of the wild strains in the fermentation lead to the low output, which is not stable, either. In order to improve the yield of fermentation, we can control the metabolic pathway of synthesis of adenosine fermentation strains artificially according to molecular biology methods. According to the single and double crossover homologous recombination techniques, this experiment constructs two targeted knockout of adenosine biosynthesis of GMP synthase gene mutations in guaA gene plasmid to provide the basis for the downstream metabolic pathway by molecular biological methods to control the synthesis of adenosine fermentation.
Keywords: adenosine;metablism;mutation;single crossover recombination;double crossover recombination
目 录
摘要 I
Abstract II
第一章 文献综述 1
1.1腺苷概况 1
1.1.1 腺苷的化学性质 1
1.1.2 腺苷的药理作用 2
1.1.3 生产方法与研究进展 2
1.2 枯草芽孢杆菌基因突变质粒的构建和基因敲除 5
1.2.1 双交换同源重组 5
1.2.2 单交换同源重组 6
1.3本课题研究的目的和意义 7
第二章 guaA基因单交换突变质粒的构建 8
2.1 实验材料 8
2.1.1 菌株和质粒 8
2.1.2 主要试剂和工具酶 8
2.1.3 主要实验仪器 9
2.1.4 培养基、溶液和抗生素 9
2.1.5 PCR引物合成 10
2.2 实验方法 10
2.2.1 分子生物学基本操作 10
2.2.3 GMP合成酶基因(guaA)与T载体的连接 11
2.2.4 E. coli JM109化转感受态细胞的制备 12
2.2.5 pMD19-T-guaA连接产物的转化和阳性转化菌株的鉴定 13
2.2.6 大肠杆菌的保存 14
2.2.7 酶切位点的选择 14
2.2.8 GMP合成酶基因(guaA)的突变基因guaA-T的PCR扩增 14
2.2.9 guaA-T与T载体的连接 15
2.2.10 pMD19-T-guaA-T连接产物的转化和阳性转化菌株的鉴定 15
2.2.11 双酶切反应 15
2.2.12 基因片段与载体片段的连接 16
2.2.13 pMarC-guaA-T连接产物的转化和阳性转化菌株的鉴定 17
2.3 结果与分析 18
2.3.1 克隆及构建策略 18
2.3.2 guaA基因的PCR扩增 19
2.3.3 pMD19-T-guaA阳性转化菌株的筛选与鉴定 20
2.3.4 guaA的突变基因guaA-T的PCR扩增 22
2.3.5 pMD19-T-guaA-T阳性转化菌株的筛选与鉴定 22
2.3.6 pMarC-guaA-T重组质粒的阳性转化菌株的筛选与鉴定 23
第三章 guaA基因双交换突变质粒的构建 25
3.1 实验材料 25
3.1.1 菌株和质粒 25
3.1.2 主要试剂盒工具酶 25
3.1.3 主要实验仪器 26
3.1.4 培养基、溶液和抗生素 26
3.1.5 PCR引物合成 26
3.2 实验方法 27
3.2.1 融合PCR基因片段的获得 27
3.2.2 融合PCR反应 28
3.2.3 融合PCR产物与T载体的连接 29
3.2.4 连接产物的转化和阳性转化菌株的鉴定 30
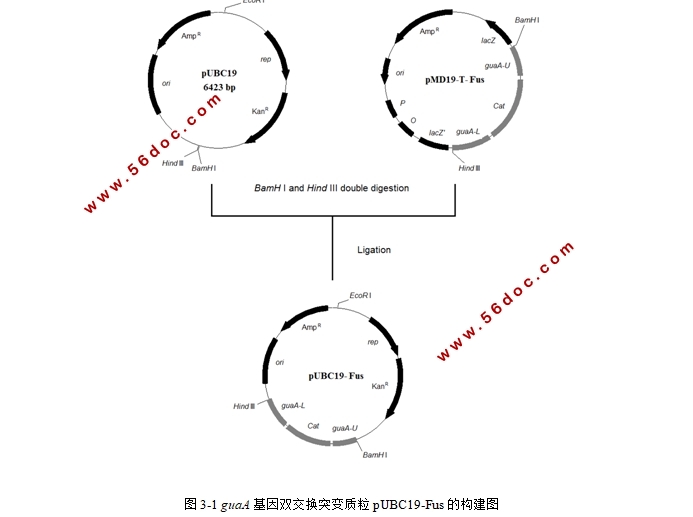
3.2.5 双酶切反应 30
3.2.6 融合片段与载体片段的连接 31
3.2.7 pUBC19-Fus重组质粒的阳性转化菌株的筛选与鉴定 32
3.3 结果与分析 33
3.3.1 克隆及构建策略 33
3.3.2 融合PCR基因片段的PCR扩增 34
3.3.3 融合PCR反应 35
3.3.4 pMD19-T-Fus阳性转化菌株的筛选与鉴定 35
3.3.5 pUBC19-Fus重组质粒的阳性转化菌株的筛选与鉴定 38
第四章 总结与展望 40
参考文献 41
致谢 43
|