干细胞分化过程中的荧光示踪体系构建
来源:56doc.com 资料编号:5D6119 资料等级:★★★★★ %E8%B5%84%E6%96%99%E7%BC%96%E5%8F%B7%EF%BC%9A5D6119
资料以网页介绍的为准,下载后不会有水印.资料仅供学习参考之用. 密 保 惠 帮助
资料介绍
干细胞分化过程中的荧光示踪体系构建(12000字)
摘 要:目的 构建含强启动子和双报告基因(绿色荧光蛋白及荧光素酶报告基因)的慢病毒骨架质粒(Lv-Ef1α-LUC-IRES-EGFP),并扩增出预测的胰岛素启动子片段,为研究干细胞向胰岛分化过程中的示踪方法奠定了基础。方法 设计引物,采用PCR技术扩增LUC报告基因及预测的INS启动子片段,并构建Lv-ef1α-LUC-IRES-EGFP慢病毒骨架质粒。结果:成功构建了含双报告基因的慢病毒骨架质粒,并成功扩增得到预测的胰岛素启动子片段。
关键词:干细胞;分化;示踪;慢病毒
The Florescent Imaging System during The Differentiation of Stem Cells
—Construction of Double Reporter Gene System and Cloning of Insulin Promoter
Abstract: Objective: The lentiviral skeleton plasmid (Lv-ef1α-LUC-IRES-EGFP) containing ef1α promoter gene and double reporter gene (Firefly Luciferase and Green Fluorescent Protein reporter gene) was constructed, which laying a foundation on imagine the process of inducing the embryonic stem cells into pancreas Cells. Methods: To design primers, gene segments of anticipatory insulin promotor and LUC reporter gene were cloned by PCR technology, and constructed Lv-ef1α-LUC-IRES-EGFP lentiviral skeleton plasmid. Results: The plasmid Lv-ef1α-LUC-IRES-EGFP is constructed, and the gene segment of anticipatory insulin promotor was cloned successfully.
Key words: Stem Cells; Differentiation; Imaging; Lentivirus
目 录
摘 要 1
关键词 1
1 前言 2
1.1 胚胎干细胞 2
1.1.1 胚胎干细胞的应用前景 2
1.2 示踪体系中的报告基因 2
1.2.1 荧光素酶 3
1.2.2 绿色荧光蛋白 3
1.3 胰腺细胞特异性启动子 4
1.3.1 胰腺细胞特异性标志物 4
1.3.2 特异性启动子 4
1.4 慢病毒载体 4
1.4.1 慢病毒载体的特点 4
1.5 糖尿病简介 5
2 材料和方法 5
2.1 实验材料与仪器 5
2.1.1 实验材料 5
2.1.2 主要仪器 6
2.1.3 溶液配制 6
2.2 实验方法 7
2.2.1 构建Lv-ef1α-LUC-IRES-EGFP质粒 7
2.2.2 质粒大量提取 11
2.2.3 慢病毒制备 12
2.2.4 重组质粒功能鉴定 13
2.2.5 克隆特异性启动子 14
3 实验结果与分析 15
3.1 荧光素酶的克隆 15
3.1.1 LUC温度梯度PCR产物电泳鉴定 15
3.1.2 在最佳退火温度下克隆回收LUC基因 16
3.1.3 双酶切PCR产物回收鉴定 16
3.2 重组质粒鉴定 17
3.3 辅助质粒双酶切鉴定 17
3.4 质粒大量提取浓度检测 18
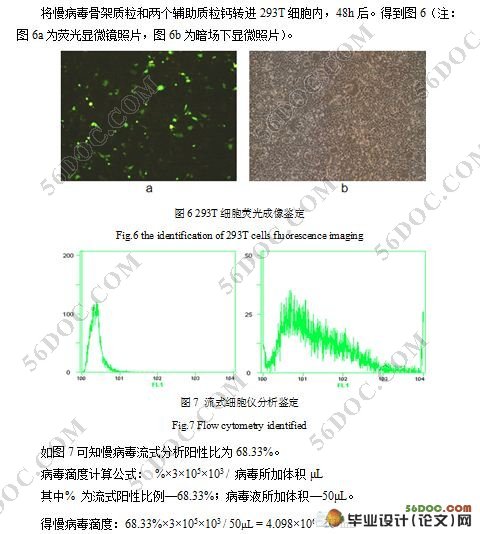
3.5 慢病毒制备及滴度检测 18
3.6 慢病毒功能鉴定 19
3.6.1 慢病毒感染MDA-MB-231细胞 19
3.6.2 荧光素酶测定 19
3.7 扩增特异性启动子 20
3.7.1 胰岛素启动子温度梯度PCR鉴定 20
3.7.2 特异性启动子回收鉴定 20
4 结论 21
参考文献 21
致 谢 22
|



